1. Reação eletroquímica
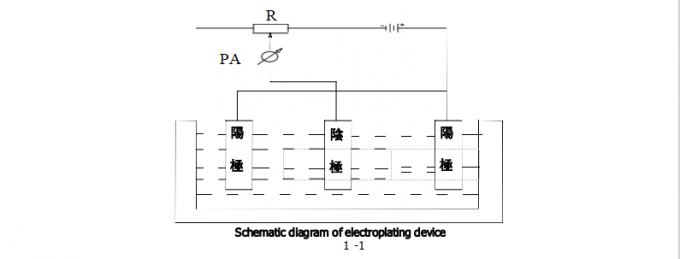
A figura abaixo é um diagrama esquemático do dispositivo de galvanização. A peça a ser chapeada é o cátodo, que é conectado ao polo negativo da fonte de alimentação de DC. O ânodo do metal é conectado ao polo positivo da fonte de alimentação de DC. O ânodo e o cátodo são imergidos na solução de chapeamento. Quando algum potencial é aplicado entre o cátodo e o ânodo, a seguinte reação ocorre no cátodo: o íon Mn+ do metal difundiu do interior da solução de chapeamento à relação entre o elétrodo e a solução de chapeamento obtém elétrons de n do cátodo e é reduzido ao metal M por outro lado, no ânodo então a reação completamente oposta ao cátodo ocorre, isto é, a dissolução do metal M ocorre na relação do ânodo, e os elétrons de n são liberados para gerar os íons Mn+ do metal.
2. A lei de Faraday
Quando as passagens atuais através da solução de chapeamento, reação eletrolítica ocorrem na solução do eletrólito, o metal no cátodo está precipitado continuamente, e o metal do ânodo é dissolvido continuamente. Consequentemente, a quantidade de precipitação (ou de dissolução) do metal deve ser relacionada à carga que passa completamente. Baseado em um grande número resultados experimentais, Faraday estabeleceu a lei do relacionamento entre (ou se dissolveu) a substância precipitada e a carga elétrica.
A primeira lei de Farah: O peso (ou se dissolveu) da substância precipitada no elétrodo é proporcional à carga passada completamente durante a reação eletrolítica, de que é: m=kQ=kIt (m é a massa da substância precipitada ou dissolvida no elétrodo; Q for a carga passada quando; K é a constante proporcional; Eu sou o atual; t é o tempo da eletrificação.
A lei de Faraday segundo: Em eletrólitos diferentes, quando a mesma quantidade de carga é passada, a quantidade de substância que precipita (ou se dissolve) no elétrodo é igual, e a quantidade de carga exigida precipitar (ou para se dissolver) 1mol de toda a substância é igual a ela é 9.65X104C. Esta constante é chamada Faraday constante, representado por F, K=M/F.
3. Eficiência atual
Durante a galvanização, a massa da substância precipitou realmente no cátodo não é igual ao resultado do cálculo obtido de acordo com a lei de Farah, e o valor real é sempre menor do que o valor calculado. Isto é porque há mais de uma reação no elétrodo. Além do que a reação principal, as reações laterais igualmente ocorrem.
4. Capacidade da dispersão de chapear a solução
A capacidade da dispersão da solução de chapeamento refere a capacidade da solução de galvanização para distribuir uniformemente a espessura da camada do metal, igualmente conhecida como a capacidade de jogo. Melhor a capacidade da dispersão da solução de galvanização, mais uniforme a espessura da camada do metal depositada nas peças diferentes do cátodo.
5. Cobertura de chapear a solução
Na produção de galvanização, um outro conceito de uso geral é capacidade da cobertura, igualmente conhecida como a capacidade de chapeamento profunda, que refere a capacidade da solução de galvanização para depositar o revestimento de metal em rebaixos profundos das peças chapeadas. A capacidade da dispersão e a capacidade da coberta são diferentes. O anterior é uma pergunta de como uniforme o metal é distribuído na superfície do cátodo. Seus locais são que há um revestimento na superfície do cátodo; quando o último referir o problema de se o metal está depositado nos rebaixos profundos da superfície do cátodo.

 Por favor verifique seu email!
Por favor verifique seu email! Por favor verifique seu email!
Por favor verifique seu email!  Por favor verifique seu email!
Por favor verifique seu email! Por favor verifique seu email!
Por favor verifique seu email! 

